올해 상반기 식품의약품안전처로부터 제약사들이 신약 또는 제네릭 개발을 위한 임상시험 승인을 받은 건수가 527건에 달하는 것으로 나타났다.
특히 제네릭 개발을 위한 생물학적동등성시험이 159건으로 전년동기 91건에 비해 68건이나 증가했다.
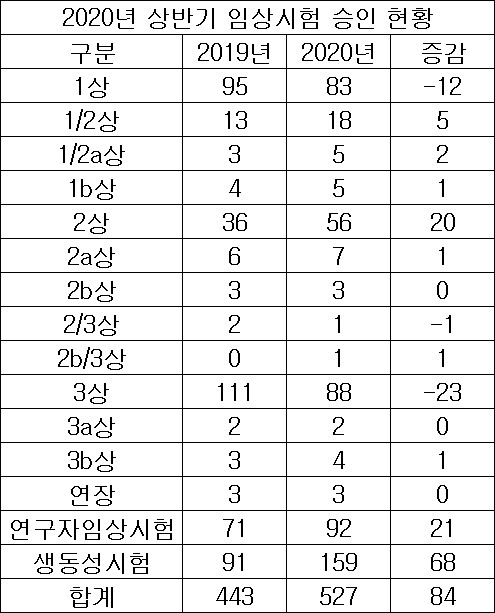
식품의약품안전처의 임상시험 승인 현황에 따르면, 올해 상반기 527건의 임상시험이 승인을 받아 전년동기 448건에 대비 84건이 늘어났다. [도표 참고]
단계별로 보면 임상 1상은 88건, 임상 2상 56건, 임상 3상 88건, 연구자임상시험 92건 등이었다.
전년동기와 비교해 임상 1상은 12건이, 임상 3상은 23건이 감소했다. 임상 2상은 56건으로 전년동기 36건에 비해 20건이, 연구자임상시험도 전년동기 71건과 비교해 21건이 늘어났다.
연구자 임상시험을 가장 많이 진행하는 곳은 서울대병원으로 17건을 승인받았으며, 그 다음으로 신촌세브란스병원과 아산병원이 각각 11건, 삼성서울대병원 7건 등의 순이었다.
연장 임상시험 한국로슈, 에스씨엠생명과학, 파머수티컬리서치에서 승인받은 3건으로 장기간의 안전성 추적관찰을 위한 것이다.
한국로슈는 알츠하이머병 환자를 대상으로 간테네루맙(GANTENERUMAB) 장기 투여의 안전성과 내약성을 평가하기 위한 라벨 공개, 다기관, 인계(rollover) 임상시험을, 에스씨엠생명과학은 ADT2002 시험에 참여했던 시험대상자에서 SCM-AGH에 대한 장기 안전성 추적관찰 시험을, 파머수티컬리서치는 궤양성 대장염(UC)이 있는 시험대상자에서 TD-1473의 안전성과 내약성을 평가하는 3년간의 다기관 장기적 안전성(LTS) 임상시험을 승인받았다.
올 상반기에는 임상 0상과 임상 4상을 승인받은 곳은 한 곳도 없는 것으로 나타났다.
제네릭 개발을 위한 생물학적동등성시험이 올 상반기 큰 폭으로 증가한 것은 정부의 약가정책 변화로 인해 제네릭에도 약가가 차등 적용되면서 제약사들이 공동생동하기 보다는 직접 생동으로 전환했기 때문이란 분석이다.
임중선 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.