해외진출 209개사에 달해
법인 114곳·생산시설 23곳
바이오시밀러 성과 가장 높아
한정된 국내 시장에서 벗어나 글로벌 제약사로 성장하기 위한 움직임이 활발하다. 특히 의약품 선진시장이라고 할 수 있는 미국과 유럽 시장에 진출하는 곳이 늘어나고 있다.
최근들어 미 FDA와 EMA의 시판허가를 받는 제품들이 증가하는 경향을 보이면서 국내 제약사들의 진출이 활발하게 이뤄지고 있다.
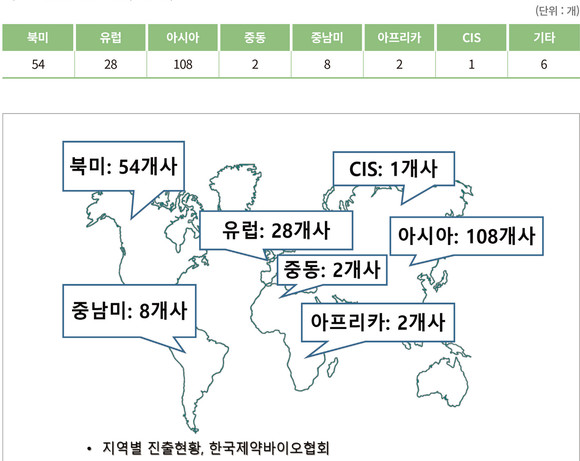
국내 제약사 중에서 해외에 진출한 곳이 209개사에 달한다. 지역별로는 아시아 지역이 108곳으로 가장 많으며, 그 다음으로 북미 54곳, 유럽 28곳, 중남미 8곳 등의 순이었다.
해외진출 형태를 보면, 해외법인이 144곳, 생산시설 및 연구시설이 각각 23곳, 마케팅 지사 19곳 등이다.
미 FDA의 시판 승인을 받은 품목을 보면 2019년에만 8개 품목에 달했다. 삼성바이오에피스의 ‘온트루잔트’를 시작으로 대웅제약 ‘주보’, SK바이오팜 ‘수노시’, 셀트리온 ‘리네졸리드’, 삼성바이오에피스 ‘에티코보’와 ‘하드리마’, SK바이오팜 ‘엑스코프리’, SK케미칼 ‘SID 710’ 등이다.
EMA의 시판허가를 받은 제품이 상당수가 바이오시밀러이다. 셀트리온이 4개 품목을, 삼성바이오에피스가 4개 품목의 시판허가를 받았다.
동아ST의 항생제 ‘시벡스트로’와 SK케미칼이 혈우병치료제 ‘앱스틸라’, 대웅제약의 보톨리늄 ‘누시바’ 등이 시판허가를 받았다.
미국과 유럽 시장에서 가장 큰 성과를 보이는 것은 바이오시밀러이다. 셀트리온과 삼성바이오에피스는 바이오시밀러를 미국과 유럽에서 잇달아 시판하면서 글로벌 바이오시밀러 시장을 선점해 나가고 있는 상황이다.
셀트리온이 글로벌 시장 상업화에 성공한 자가면역질환 치료제 램시마(CT-P13)는 전 세계 최초의 단일클론 항체 바이오시밀러 제품이다. 2013년 유럽연합 집행위원회로부터 오리지널 제품과 동일한 적응증으로 판매허가를 획득했다.
2016년에는 미국 FDA로부터 허가를 신청한 모든 적응증에 대해 판매승인을 받았다.
글로벌 제약시장 조사기관인 IQVIA에 따르면 주요 시장인 유럽 시장 내 램시마의 시장 점유율은 2019년 2분기말 기준으로 약 59%에 달하며. 미국 시장의 경우 2016년말 판매를 개시한 이후 꾸준히 판매량이 증가하고 있는 추세이다.
후속 제품인 혈액암 치료제 트룩시마(CT-P10)는 2017년 2월에는 유럽 EMA로부터 오리지널 제품과 동일하게 모든 적응증에 대한 판매 허가를 획득했으며, 2017년 4월부터 영국, 독일 등 유럽 국가에서 판매를 시작했다. 유럽 시장내 점유율은 2019년 2분기말 기준으로 약 38%에 달한다.
미국에서는 2018년 11월 FDA에서 최종 허가를 받았으며, 2019년 11월 현재 미국 시장에서 판매를 개시했다.
유방암 치료제 허쥬마(CT-P6)는 2018년 2월 유럽 EMA로부터 오리지널 제품과 동일하게 모든 적응증에 대한 판매 허가를 받았으며 2018년 2분기부터 판매를 시작해 2019년 2분기말 기준 시장 점유율은 15%로 같은 시기에 출시된 경쟁 바이오시밀러 제품 대비 높은 점유율을 기록하고 있다.
미국의 경우 2018년 12월 FDA로부터 최종 허가 신청 받았으며, 현재 판매 개시를 위한 준비중에 있다.
삼성바이오에피스는 휴미라(성분명 아달리무맙) 바이오시밀러 ‘임랄디’를 통해 유럽 시장을 빠른 속도로 점유해 나가고 있다.
유럽 아달리무맙 바이오시밀러 시장의 46%를 점유하면서 경쟁사인 암젠, 산도즈 등보다 앞서 나가고 있다.
엔브렐 바이오시밀러인 ‘베네팔리’도 40%의 시장 점유율을 기록하면서 유럽시장에서 성공적인 모습을 보여주고 있다.
삼성바이오에피스는 미국 시장 진출을 위한 다양한 노력을 기울이고 있다. 지난해 11월 아바스틴 바이오시밀러인 ‘SB8’에 대한 품목허가 신청서를 미 FDA에 제출했다. 이에 앞서 7월에는 유럽 판매허가를 신청해 놓은 상황이다.
이미 미 FDA의 시판허가를 받은 제품은 ‘렌플렉시스(레미케이드 바이오시밀러)’, ‘에티코보(엔브렐 바이오시밀러)’, ‘하드리마(휴미라 바이오시밀러)’, ‘온트루잔트(허셉틴 바이오시밀러)’ 등 4개 품목이다.
삼성바이오에피스는 최근 글로벌 바이오시밀러 시장 공략을 위해 마케팅 파트너십 협력을 강화하고 기존 자가면역질환 및 종양질환 외 다양한 영역으로 바이오시밀러 연구개발을 확대해 나가고 있다. 희귀질환 치료제 SB12(솔리리스 바이오시밀러, 성분명: 에쿨리주맙) 은 현재 임상3상 단계를 진행 중이며, 안과질환 치료제 SB11(루센티스 바이오시밀러, 성분명: 라니비주맙)과 SB15(아일리아 바이오시밀러, 성분명: 애플리버셉트) 도 현재 임상 3상 진행 및 준비 중에 있다.
임중선 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.