지난해 제네릭 개발을 위한 생물학적동등성시험 승인이 큰 폭으로 증가한 것으로 나타났다.
대학병원 중심으로 이뤄지는 연구자임상시험은 2018년과 동일한 154건이 승인됐다.
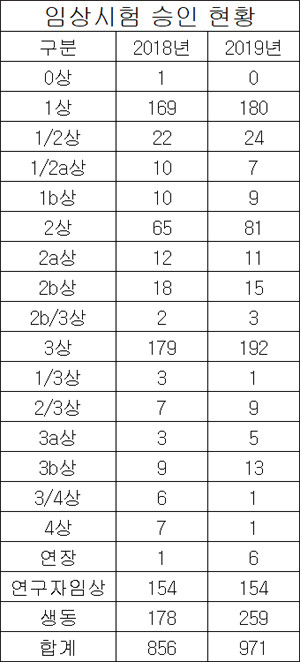
식품의약품안전처에 따르면, 지난해 승인을 받은 임상시험은 971건으로 전년 856건에 비해 13.43%가 증가했다.
지난해 가장 많은 승인을 받은 것은 생물학적동등성시험으로 259건이 승인됐으며, 전년 178건 대비 45.51%가 증가한 수치다.
이처럼 생동시험이 큰 폭으로 증가한 것은 정부가 제네릭 개편안을 발표하면서 약가 및 허가정책에서 우위를 보이기 위한 사전 준비를 제약사들이 진행했기 때문이라는 분석이다.
실제 ‘1+3’ 조치와 2023년 허여 금지가 예정돼 있으며 약가도 조건에 따라 최대 38.69%까지 줄어든다.
임상시험 단계별 승인 현황을 보면, 임상 1상은 180건으로 전년 169건에 비해 6.51%가, 임상 2상은 81건으로 2018년의 65건보다 24.62%가 증가했다.
임상 3상은 192건으로 전년 179건에 비해 7.26%가, 연장 임상시험은 6건으로 2018년 1건에 비해 5건이 늘었으며, 연구자 임상시험 154건으로 2018년과 승인받은 건수가 동일했다.
임상 1상과 임상 2상이 증가하는 것에 대해 제약업계에서는 긍정적인 평가를 내리고 있다.
국내 제약사들의 신약개발을 연구가 진행되면서 실제 임상시험 단계에 돌입하는 성과가 늘어나고 있다는 설명이다.
임중선 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.