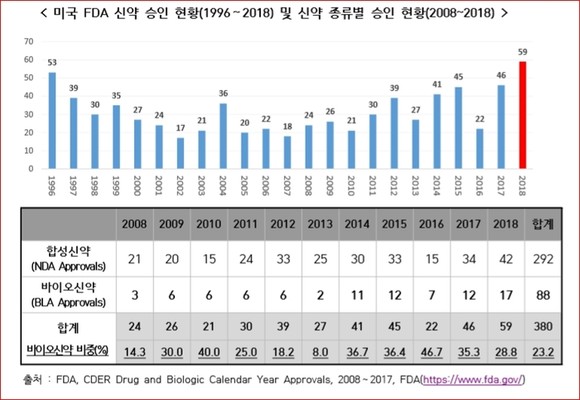
미국 식품의약국(FDA)의 2018년 신약 허가건수는 59건으로 전년도 46건 보다 13건이 증가해 역대 최다 승인건수를 기록한 것으로 파악됐다.
이같은 기록은 미국이 희귀의약품 지정 등 신속심사 및 허가제도(신속심사, 획기적치료제 지정, 우선심사, 가속승인)의 적극적인 활용으로 승인건수가 크게 증가한 것으로 분석됐다.
생명공학정책연구센터가 최근 발간한 BioINwatch에 따르면 미국 FDA의 신약 허가건수는 트럼프 정부 출범 이후 추진된 규제완화 정책으로 신약 승인이 가속화되어 2016년 22건에서 2017년 46건, 2018년 59건의 신약을 승인했다.
1996년 53건의 신약이 승인된 이래 최다 승인이며, 승인된 신약 중 바이오신약의 비중은 2014년 이후 30% 수준을 유지하고 있다.
2018년 FDA 의약품평가연구센터(Center for Drug Evaluation and Research, CDER)의 분석결과,신약승인 증가는 도움이 필요한 환자에게 새롭고 혁신적인 치료법을 제공하여 환자 치료 및 국민 건강 향상에 기여한 것으로 평가됐다.
또한 희귀질환 및 전염병 등 공공성 및 unmet needs가 높은 질환에 대한 신약 허가가 많았던 것으로 조사됐다.
59건의 신규허가 중 34건이 희귀질환 환자 치료 관련 신약으로 구루병, Fabry 질환, phenylketonuria(PKU) 치료제 등이 승인됐다.
승인된 신약의 유형별로 59건의 신약 중 32%인 19개가 First-in-class (혁신신약)로 승인 58%인 34개는 희귀질환(Rare Diseases) 치료제로, 73%인 43개는 하나 이상의 신속심사 및 허가제도(신속심사, 획기적치료제 지정, 우선심사, 가속승인)를 통해 승인받은 것으로 분석됐다.
59건 중 24건은 신속심사로, 14건은 획기적치료제 로,43건은 우선심사 대상으로 지정, 4건은 가속승인 대상으로 지정됐다.
또한 59건 중 71%인 42건은 다른 국가에서 승인받기 전에 미국에서 최초로 승인됐다.
홍유식 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.